مقدمه ای بر متالورژی آلیاژهای آهنی_بخش۲

اکسیژن زدایی و گوگرد زدایی
فولاد مذابی که از کوره فولادسازی بدست می آید حاوی مقادی زیادی اکسیژن حل شده است که باید پیش از ریخته گری فولاد، چه بصورت پیوسته (مداوم) و چه به صورت شمش، حذف گردد. اکسیژن زداهایی که معمولا برای این منظور مورد استفاده قرار می گیرند آلومینیوم و سیلیسیم (به شکل فروسیلیکون) هستند. حذف اکسیژن از فولاد را آرام سازی (killing) می خوانند و عبارتهای آرام شده با سیلیسیم یا آلومینیوم از اینجا آمده اند.
فولاد کاملاآرام (fully killed) فولادی است که ترکیب شیمیایی و خواص نسبتا همگنی دارد. به فولاد نیمه آرام (semi‐killed) اکسیژن زدای کمتری نسبت به فولاد کاملا آرام اضافه می شود و از این فرآیند برای فولاد های کم کربن و کربن متوسط برای مصارف سازه ای استفاده می گردد. فرآیند اکسیژن زدایی در مورد برخی فولادها انجام نمی گردد و اکسیژن باقی مانده در فولاد با کربن واکنش داده و ایجاد تخلخل (حفره های گازی) که در حقیقت گاز اکسید کربن (CO) است، می کند.
این فولادهای نا آرام یا جوشان (rimmed steel) دارای تغییرات زیادی در ترکیب شیمیایی هستند به گونه ای که پوسته خارجی آنها شامل آهن خالص، کربن اندک و فسفر و گوگرد است. این عناصر با مقادیری بیش از مقدار متوسط، در مرکز شمش یافت می شوند. لبه هایی با خلوص بالاتر باعث می شود این نوع فولاد برای تولید ورقهای فولادی کم کربن با سطح تمام شده مناسب ، به کار رود.
فولادهای سر دار ((capped steel بین فولادهای نا آرام و نیمه آرام قرار دارند و برای تولید ورق، نوار، سیم و .. با کربن بیش از ۱۵/۰ درصد مناسبند.
منشا گوگرد موجود در فولاد، زغال سنگ است که پس از تبدیل به کک بعنوان سوخت و احیاء کننده در کوره بلند کاربرد دارد. عموما منگنز به فولاد اضافه می شود تا سولفید منگنز بجای سولفید آهن(FeS) تشکیل گردد زیرا سولفید آهن در نورد گرم ذوب شده و باعث ترد شدن فولاد یا ایجاد شکنندگی داغ (hot shortness) می شود. چون ناخالصی های سولفید منگنز باعث کاهش چقرمگی شکست ( fracturetoughness) می شوند، در کوره های جدید از روشهای مختلفی برای گوگرد زدایی استفاده می گردد. به عنوان مثال تزریق موادی مانند کاربید کلسیم( ۲(CaCیا سیلیسید کلسیم(۲CaSi) به آهن مذاب یا فولاد به منظور حذف گوگرد. به همین دلیل است که بیشتر فولادهای مدرن مقادیر گوگرد کمتری نسبت به مقادیر مجاز چند دهه گذشته دارند.
آهن خالص و آلوتروپی های آن
آهن فلزی خالص کاربرد بسیار محدودی در مهندسی دارد چون دارای استحکام بسیار پائین و مقاومت اندک در برابر خوردگی است. چگالی آن (وزن مخصوص ۸۷/۷ ) کمی کمتر از مس است و دمای ذوب آن ۱۵۴۰ درجه سانتیگراد است که قدری بیشتر از نیکل و خیلی بیشتر از مس و آلومینیوم است. آهن خالص جامد بین دمای محیط و دمای ذوبش، دچار دو تغییر در ساختمان بلوری می شود که به آنها تغییر فازهای آلوتروپیک گفته می شود. پس آهن خالص دارای دو نوع ساختمان بلوری است، یکی در دماهای پایین و بالا و دیگری در دماهای بینابین. زیر ۹۱۲ درجه سانتیگراد، آهن دارای ساختمان بلوری مکعب مرکز دار (bcc) است که ترتیب قرار گرفتن اتم ها در شکل ۱ آمده است. این ماده، آهن آلفا (α‐iron) نامیده می شود.
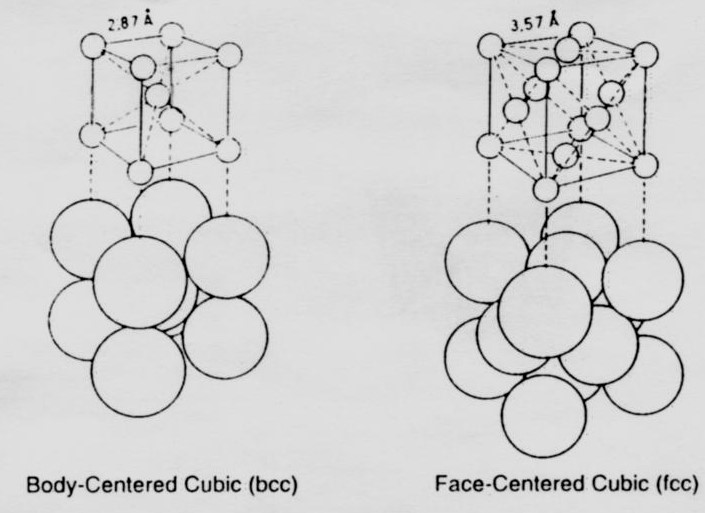
شکل۱- ساختمان بلوری آهن
در دماهای خیلی بالاتر از C° ۱۳۹۵ تا نقطه ذوب، آهن همچنان دارای ساختمان بلوری bcc است و در این دامنه دمایی به آن آهن دلتا (δ ‐iron) می گویند. در دماهای متوسط بین C° ۹۱۲ و C° ۱۳۹۵ ساختمان بلوری آهن، مکعب با وجوه مرکز دار (fcc) است که نحوه چیدمان اتمها در شکل ۱ قابل مشاهده است.
این آهن گاما (γ – iron) نامیده می شود. بنابراین اگر آهن به آهستگی از دمای محیط تا بیش از نقطه ذوبش گرم شود چند تغییر فاز (دگرگونی فاز) رخ می دهد و در طی کردن این مسیر به صورت معکوس یعنی سرد کردن آهسته از بالای نقطه ذوب تا دمای محیط باز هم این اتفاق می افتد. ذکر این نکته لازم است که این تغییرات در سرد کردن آهسته اتفاق می افتد و اگر سرعت سرد کردن خیلی زیاد باشد ممکن است رفتار آهن به گونه ای دیگر باشد که بعدا در مورد آن بحث می شود.
آلیاژهای آهن – کربن
وجود کربن و عناصر آلیاژی رفتار آلوتروپی را پیچیده تر می کند و فرصت ایجاد دامنه گسترده ای از خواص و ریز ساختار را بوجود می آورد. در این فرآیند، تاثیرکربن از همه بیشتر است. کربن در آهن bcc حل شده و یک محلول جامد به نام فریت (ferrite) تشکیل می دهد. اما حل شوندگی کربن بسیار کم است و حداکثر به میزان ۰۲۵/۰ درصد کربن در دمای C° ۷۲۵ در فریت آلفا (α) و فقط ۰۹/۰ درصد کربن درC° ۱۴۹۵ در فریت δ (به صورت قرارداد عبارت فریت معادل با فریت α و عبارت فریت δ برای اشاره به فاز موجود در دمای بالا بکار می رود).
از سوی دیگر در آهن γ با ساختمان بلوری fcc قابلیت انحلال کربن اندکی بیشتر است و به حداکثر میزان ۱/۲ درصد کربن در دمای °C1150 می رسد. محلول جامد fcc کربن در آهن fcc آستنیت(austenite) خوانده می شود. هم فریت و هم آستنیت محلول جامد بین نشین هستند یعنی اتمهای کربن به این صورت در آهن حل می شوند که در مکانهای بین نشین (میان اتمهای آهن) در شبکه بلوری fcc یا bcc قرار می گیرند.
شکل ۲ ساختار fcc آستنیت را نشان می دهد که در آن برخی از مکان های بین نشینی شبکه به وسیله اتمهای کربن پر شده اند. فریت و آستنیت فاز هستند چون آنها از لحاظ فیزیکی همگن و از لحاظ ساختاری اجزاء مجزای ریز ساختار یک آلیاژ را تشکیل می دهند. فازهای دیگری که می توانند در آلیاژهای آهنی ایجاد شوند را در زیر مورد بحث قرار می دهیم.
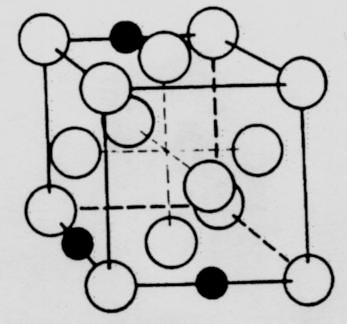
شکل۲ – کربن به صورت بین نشین در آستنیت fcc حل شده است. اتم های کربن با دایره های سیاه و اتمهای آهن با دایره های سفید مشخص شده اند.
دامنه دمایی بالایی که ساختمانهای بلوری fcc و bcc پایدار هستند توسط حضور کربن تاثیر می پذیرد. کربن حد پائین پایداری فاز fcc را از C° ۹۱۲ به پائینتر از C° ۷۲۵ کاهش داده و حد بالایی را از C° ۱۳۹۵ به بالای C° ۱۴۹۵ افزایش می دهد. این مطلب در شکل۳ نمایش داده شده است و در آن حدود دقیق به میزان کربن بستگی دارد.
نویسنده: آقای مهندس کامران خداپرستی